رحم محل پیچیدهترین شاهکار زیستشناسی انسان است: دگرگونی از رویان به جنین و سپس به نوزاد؛ اما این تحول عظیم بدون جفت، اندام حیاتبخشی که رشد جنین از طریق بند ناف به آن گره خورده است، غیر ممکن است.
حتی قبل از اینکه زنی بداند که باردار است، جفت از نظر اندازه بزرگ میشود و آماده است تا زمانیکه جنین کلیه و کبد خود را بسازد، کار این اعضا را برای او انجام بدهد. جفت هنگام ۱۲ هفتگی جنین، تنفس برای جنین را آغاز میکند. روی سطح پیچخوردهای که به اندازهی کافی بزرگ میشود که بتواند اسبی را بپوشاند، خون جنینی در یک سمت اکسیژن خون مادر را که در سمت دیگر جفت قرار دارد، میگیرد. اکسیژن مادر بهطور پیوسته وارد قلب تپنده، مغز و اندامهای جنین میشود و کربن دیاکسید جنین به خون مادر برمیگردد تا طی بازدم خارج شود.
بازآفرینی آنچه در درون رحم رخ میدهد، بدون تردید به قلمرو داستانهای علمی-تخیلی تعلق دارد. هنوز موارد زیادی وجود دارد که دانشمندان در مورد مراحل اولیهی رشد، یعنی زمانیکه سلولهای جنینی به اعضا و بافتهای بدن تبدیل میشوند، نمیدانند؛ اما جورج مایچالیسکا فکر میکند ایجاد نسخهای مصنوعی از جفت یا حداقل بازسازی مهمترین عملکردهای آن امکانپذیر است. او بهعنوان جراح جنین و کودک در بیمارستان کودکان سیاسموت دانشگاه میشیگان اغلب نوزادان نارسی را میبیند که خیلی زود رحم را ترک کردهاند. اگرچه پزشکی مدرن میتواند بسیاری از آنها را نجات بدهد، شانس زنده ماندن نوزادان بسیار نارس (آنهایی که سنشان کمتر از ۲۸ هفته است، یعنی بهسختی در سهماههی سوم خود هستند) بسیار کم است.
بسیاری از بازماندگان با مشکلات سلامتی طولانیمدتی روبهرو هستند. ریهها به گونهای طراحی نشدهاند که تا زمان کامل شدن دوره یعنی ۳۹ هفتگی، نفس بکشند و حتی ظریفترین تکنیکها برای کمک به تنفس میتواند به بافت ریه آسیب بزند. مایچالیسکا میگوید: «بهعنوان پزشک کودک در موقعیت قرار داریم اگر هیچ کاری انجام ندهیم، آنها میمیرند. اگر بخواهیم آنها را نجات دهیم، ممکن است زنده بمانند اما احتمالا براثر خود درمان به درجات مختلفی دچار بیماری ریه خواهند شد».
بیش از یک دهه است که مایچالیسکا روی راهحلی کار میکند: جفتی مصنوعی که نوزادان نارس بسیار کوچک را تا زمانیکه خودشان بتوانند نفس بکشند، زنده نگه دارد. او ثابت کرده است که جفت مصنوعی میتواند برههای نارس را برای چند هفته حفظ کند. ساختن دستگاه تنفسی برای نوزادی نارس کاری پیشپاافتاده نیست، زیرا اندازه کوچک و فیزیولوژی شکنندهی نوزاد چالشهای مهندسی و پزشکی مختلفی ایجاد میکند. تیم مایچالیسکا در حال اصلاح و تطابق فناوریهای موجود برای کار قابل اعتماد با ظریفترین عروق خونی و ساخت مواد سازگار با بیولوژی منحصربهفرد جنین بوده است. حال پس از چندین موفقیت اخیر، مایچالیسکا فکر میکند که جفت مصنوعی گروه او تنها پنج سال با کارآزماییهای انسانی فاصله دارد. سیستم او یکی از چند طرح در حال توسعه در سراسر جهان با هدف کمک به تنفس نوزادان بسیار نارس است.
برخی از سیستمهای مذکور با غوطهور کردن جنین در حمامی مایع از محیط جنینی تقلید میکنند که به شرایط رحم مصنوعی نزدیکتر میشود. طرحهای دیگران متکی بر فناوری جدیدی است که تلاش دارد تا از روش تنفس ریهها تقلید کند.
همانطور که این دستگاهها به کارآزماییهای بالینی در انسان نزدیکتر میشوند، سؤالات اخلاقی در مورد اینکه این فناوری و جامعه به کجا خواهد رفت، ایجاد میشود؛ اما پژوهشگران روی کاربرد نجاتبخش زندگی این مطالعات تمرکز دارند. دیوید وینبرگ، رئیس پروژه جفت انسان در مؤسسه ملی سلامت کودک و رشد انسان در بتسدا میگوید: «این فناوری امید زیادی برای کودکانی به همراه دارد که زودتر از موعد به دنیا میآیند». او درحالیکه هشدار میدهد قبل از اینکه چنین فناوریهایی بتواند در کلینیک استفاده شود به آزمایشهای بیشتری نیاز است، از توانایی پژوهشگران در مورد فکر کردن در مورد تمام فرایندهای موردنیاز برای زنده نگه داشتن جنین تحت تأثیر قرار گرفته است و میگوید کار آنها شگفتانگیز است.
ایده جفت مصنوعی به بیش از نیم قرن پیش بازمیگردد. در سال ۱۹۵۳، جراحان آمریکایی که روی قلب بیمار بزرگسالی عمل جراحی انجام میدادند، با موفقیت دستگاه قلب و ریه را برای اکسیژنرسانی خارجی خون بیمار به کار گرفتند. در دههی بعد، دانشمندان مشتاق بودند که فناوری جدید را روی نوزادان نارس امتحان کنند. بههرحال، اکسیژنرسانی خون در خارج از بدن کاری است که جفت برای جنین انجام میدهد. در آن زمان، در بسیاری از بیمارستانها حتی واحد مراقبتهای ویژه برای مراقبت از نوزادان بیمار وجود نداشت؛ اما در آزمایشهای انجامشده روی برههای نارس، اکسیژناتورهای اولیه به دلایلی که کاملا روشن نیستند، نتوانستند حیوانات را برای مدت طولانی زنده نگه دارند. در همین حین، تکنیکهای تهویهی خاص برای نوزادان و نیز داروهایی برای تقویت عملکرد ریه آنها در حال ظاهر شدن بود و به بقای هزاران نوزاد زودرس کمک کرد. به این ترتیب، علاقه به جفت مصنوعی از بین رفت.
اما با آغاز هزارهی جدید، نوع جدیدی از اکسیژناتورها در بیمارستانها به کار گرفته شد که تا حد زیادی حاصل تلاشهای رابرت بارتلت، جراح دانشگاه میشیگان بود. رابرت بارتلت با عنوان پدر اکسیژناسیون غشایی برونپیکری (ECMO) شناخته میشود.
در اولین اکسیژناتورها خون بهطور مستقیم در معرض هوا قرار میگرفت که میتواند موجب ایجاد حبابهایی شود که عروق خونی را مسدود میکند. این اکسیژناتورها نمیتوانستند برای مدت طولانی از بیماران حمایت کنند. مشخص شد اکسیژناسیون غشایی برونپیکری که متکی بر نوع جدیدی از اکسیژناتور بودند، رویکرد پایدارتر و ایمنتری هستند.
درون اکسیژناتور و در قلب سیستم ECMO، اکسیژن از مجموعهای از رشتههای توخالی ساختهشده از غشای پلاستیکی عبور داده میشود و همانطور که خون در اطراف رشتهها جریان پیدا میکند، اکسیژن به درون خون بیمار منتشر میشود. سلولهای قرمز خون اکسیژن را میگیرند و کربن دیاکسید را به رشتهها برمیگردانند. این فناوری روی دهها هزار بیمار دچار نارسایی ریوی یا قلبی استفاده شده است و شانس بقای نوزادان زودرس را افزایش داده است.
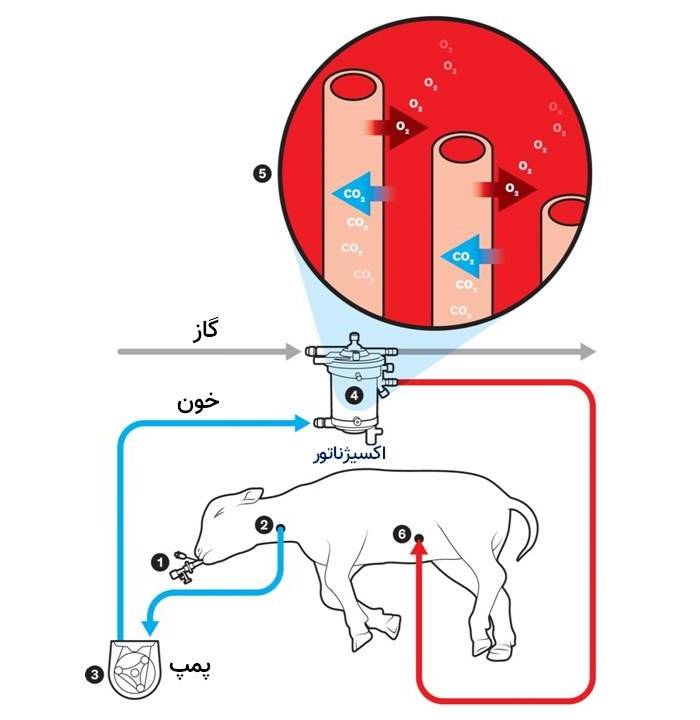
شرح تصویر: سیستمی که بهوسیلهی تیم جورج مایچالیسکا ابداع شده است، مهمترین عملکرد جفت را انجام میدهد: تأمین اکسیژن و گرفتن کربن دیاکسید. در سیستم جفت مصنوعی مایچالیسکا، ریههای گوسفند مثل حالت طبیعی که در رحم وجود دارد، همچنان پر از مایع است و لولهی تراشهای که با گیره بسته شده است (۱)، مانع از این میشود که بره شروع به تنفس کند و به ریههای نارس خود آسیب بزند. لولهای درون سیاهرگ گردن (۲) وارد میشود و خون به کمک پمپی با جریانی ثابت به خارج از بدن و به درون اکسیژناتور فرستاده میشود (۴). درون اکسیژناتور، خون در اطراف رشتههای توخالی پر از اکسیژن جریان پیدا میکند و سلولهای قرمز خون از طریق غشای رشتهها اکسیژن را گرفته و کربن دیاکسید را برمیگردانند. سپس خون اکسیژندار از طریق لولهای (۶) در سیاهرگ بند ناف به بدن بره برمیگردد. پوشش نیتریک اکسید درون لولهها و گاز نیتریک اکسید درون اکسیژناتور مانع از لخته شدن خون در هنگام عبور میشود.
اما ECMO در نوزادان بسیار نارس جوانتر از ۲۸ هفته استفاده نشده بود و نرخ ماندگاری این موجودات کوچک همچنان ضعیف بود. وقتی مایچالیسکا ۱۵ سال پیش برای ایجاد برنامه جراحی جنین به استخدام دانشگاه میشیگان درآمد، فورا به کار بارتلت علاقهمند شد. او میدانست که پزشکان فناوری ECMO را در نوزادان بسیار نارس امتحان نکردهاند، زیرا میترسیدند این سیستم برای نوزادان کوچک که وزنشان کمتر از ۵۰۰ گرم بود، بسیار بزرگ باشد. علاوه بر این، ECMO معمولا به مقادیری رقیقکننده خون یعنی هپارین برای پیشگیری از لخته شدن خون درون لولهها نیاز دارد که استفاده از آن برای نوزادان بسیار نارس غیر ممکن است، زیرا آنها مستعد مشکلات خونریزی هستند. بااینحال، مایچالیسکا میخواست آزمایش کند که آیا این اکسیژناتور را میتوان برای نوزادان بسیار نارس به کار برد.
اولین قدم این بود که سیستم را با جنینهای ۱۱۸ روزه گوسفند که ریههای آنها در مرحلهی رشد مشابه با ریههای جنین ۲۴ هفتهی انسان است، آزمایش کند. طی اولین آزمایشها در سال ۲۰۰۷، پژوهشگران حیوانات را به همان روشی که جنین به جفت متصل میشود، به اکسیژناتور ECMO وصل کردند. خون از هریک از سرخرگهای نافی بره از طریق لولهای پلاستیکی به نام کانولا خارج میشد و در اکسیژناتور به جریان درمیآمد و سپس از طریق کانولایی درون سیاهرگ نافی به بدن بره برمیگشت. مایچالیسکا امیدوار بود که قلب برهها خون را به درون سیستم مصنوعی پمپ کند اما جریان خون برهها کند شد و دو مورد نارسایی قلبی وجود داشت. او میگوید نمیتوانستیم حمایت را بیش از چهار ساعت حفظ کنیم.
تیم مایچالیسکا متوجه شد که برداشتن برهها از رحم موجب منقبض شدن سرخرگ نافی شده بود و این امر باعث شده بود کل سیستم کند شود. پژوهشگران با استفاده از سیاهرگ گردن برای ایجاد ارتباط بین خون و اکسیژناتور این مشکل را حل کردند. ازآنجا که خون در سیاهرگها به کمک نیروی ضربان قلب به حرکت درآورده نمیشود (برخلاف سرخرگها)، آنها مجبور شدند برای حفظ جریان خون از پمپ غلتکی استفاده کنند. بر اساس استدلال تیم، اگر مقاومت در مدار مصنوعی بیشتر از جفت طبیعی باشد، این روش فشار را از روی قلب در حال رشد برمیدارد.
همانطور که برههای کوچک درون انکوباتورها قرار داشتند، ریههای آنها با مایع پر بود (همانطور که بهطور طبیعی در این مرحله از رشد اتفاق میافتد). آنها در تمام طول شبانهروز تحت نظارت پزشکان و دانشجویان قرار داشتند که پمپها و اکسیژناتور را تنظیم میکردند تا غلظت اکسیژن در سطح مناسب این موجودات نارس حفظ شود. کارکنان پشتیبانی ساعت به ساعت پروتئین، قند، ویتامینها و مواد مغذی دیگر را به حیوانات میرساندند.
تا سال ۲۰۱۴، مایچالیسکا و همکارانش آنقدر روی سیستم کار کرده بودند که میتوانست برهها را برای یک هفته حفظ کند. بر اساس دادههای منتشرنشدهی اخیر، آنها از آن زمان، این بازه زمانی را به سه هفته رساندهاند. در مقابل، برههای نارسی که به دستگاه تهویه متصل بودند، معمولا طی هشت ساعت از پای درمیآمدند. پژوهشگران برای اطمینان از اینکه برهها روی جفت مصنوعی بهطور طبیعی رشد کردهاند، حیوانات را کالبدشکافی کرده و ریهها، مغز و قلب آنها را بهدقت تشریح کردند. تاکنون، نتایج خوب به نظر میرسد.
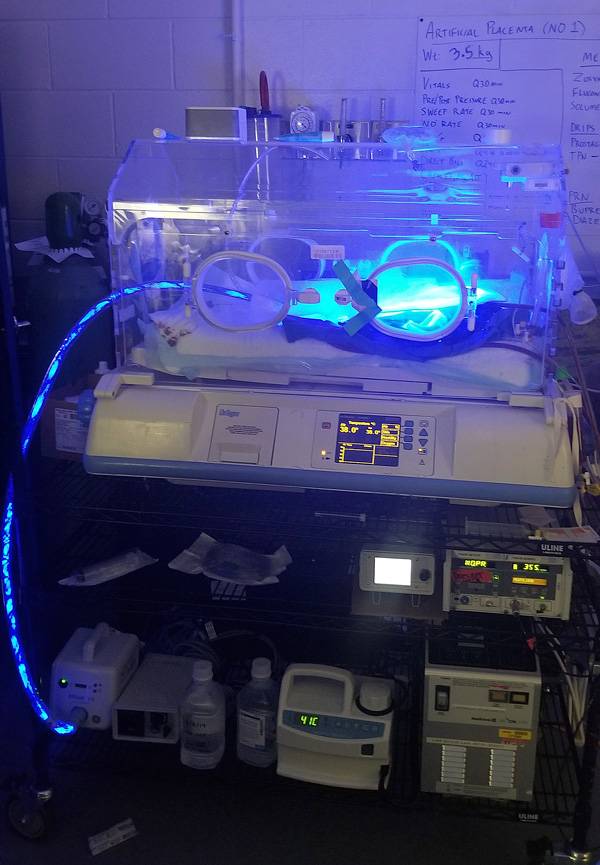
سیستم جفت مصنوعی ساختهشده به وسیلهی تیم جورج مایچالیسکا برههای بسیار نارس را برای چند هفته زنده نگه داشت. او پیشبینی میکند کارآزماییها روی نوزادان نارس انسانی طی پنج سال آغاز شود.
گروههای پژوهشی دیگر نیز نتایج مشابهی را به دست آوردهاند. در سال ۲۰۱۷، پزشکان مؤسسه تحقیقات بیمارستان کودکان فیلادلفیا (CHOP) اعلام کردند که با موفقیت برههای بسیار نارسی را که معادل نوزادان ۲۳ یا ۲۴ هفتهی انسان بودند تا چهار هفته زنده نگه داشتند. درون سیستم «کیسه زیستی» یا «بیوبَگ» آنها، جنین در مایعی مانند مایع آمنیوتیک غوطهور میشود و محیطی طبیعیتر و شبیه رحم ایجاد میکند. دستاورد پژوهشگران CHOP بهشدت تحت پوشش رسانهای قرار گرفت و گمانهزنیهایی را دراینباره ایجاد کرد این فناوری روزی بهطور کامل جایگزین بارداری میشود.
در همین حین، در دانشگاه استرالیای غربی متیو کمپ، پژوهشگر پریناتولوژی (پزشکی مادر و جنین) و همکارانش رویهای را ایجاد کردند که آن را درمان EVE یا محیط رحمی خارج از بدن مینامند. تیم کمپ با همکاری پژوهشگرانی از دانشگاه توهوکو و شرکت ژاپنی تجهیزات پزشکی نیپرو توانستند برههای کوچک را (که کمی جوانتر از برههای مایچالیسکا بودند) را برای مدت یک هفته زنده نگه دارند. کمپ نیز مانند گروه CHOP در مورد نحوهی اتصال سیستم خود به سرخرگ نافی بدون اینکه منقبض شود، کار کرده است. اگرچه در روش آنها پزشکان باید بسیار سریع عمل کنند. هر دو سیستم از قلب خود جنین برای پمپ خون استفاده میکنند که طبیعیتر است اما به گفتهی کمپ با چالشهای مختلفی روبهرو است، زیرا قلب جنین بهراحتی آسیب میبیند.
درحالیکه این نتایج امیدوارکننده است، چندین چالش عمده وجود دارد. یک مورد اینکه هنوز نمیتوان این دستگاهها را در مورد نوزادان انسانی که نمیتوان برای آنها از رقیقکنندههای خون استفاده کرد، به کار برد.
خون به چندین دلیل کابوسی برای مهندسان به شمار میرود. یکی از دلایل مهم آن است که خون هنگام برخورد با هر سطح غیرطبیعی لخته میشود. برای بیماران تحت ECMO از هپارین استفاده میشود که برای بیماران معمولی خوب است و به نظر میرسد برای برههای آزمایشهای مایچالیسکا نیز خوب باشد؛ اما استفاده از هپارین خطری غیر قابل قبول برای نوزادان دارای سن کمتر از ۲۸ هفته است، زیرا سد میان عروق خونی و بافت عصبی در حال رشد آنها هنوز بالغ نشده است. پیشگیری از لخته شدن خون میتواند موجب خونریزی مرگباری در مغز شود.
همهی گروهها با این مشکل دستوپنجه نرم کردهاند. برای تیم مایچالیسکا، دستیابی به موفقیت با کمک مارک میرهوف، شیمیدان دانشگاه میشیگان حاصل شد.
خون در حالت معمول زمانیکه در بدن انسان در گردش است، لخته نمیشود، زیرا پوشش عروق خونی جریان مداومی از گاز نیتریک اکسید را آزاد میکند که مانع از لخته شدن خون میشود. میرهوف، بارتلت و همکارانشان نوعی پلیمر مصنوعی ساختند که نیتریک اکسید منتشر میکند و آن را به پوشش لولههای پلاستیکی اضافه کردند. در ترکیب با دستگاهی که نیتریک اکسید را درون اکسیژناتور آزاد میکند، سیستم اکسیژنرسانی دیگر به هپارین نیازی ندارد. به این ترتیب، خون چنان رفتار میکند که گویی درون بدن است. مایچالیسکا میگوید آزمایشهای اخیر برای آزمایش سیستم روکشدار با برههای نارس امیدوارکننده بوده است.
شاید بزرگترین چالشی که تیمها با آن مواجه هستند، این است که نوزاد نارس انسان بسیار کوچک است. وزن برههای نارس در مرحلهی مشابهی از رشد ریه، میتواند چند کیلوگرم بیشتر از وزن نوزاد انسان باشد و این امر موجب میشود برهها بهخوبی وضعیت انسان را نشان ندهند. عرض رگهای خونی نوزاد نارس انسان فقط ۲ یا ۳ میلیمتر است، یعنی کانولایی که برای اتصال دستگاهها استفاده میشود، باید بسیار نازک باشد؛ اما با کوچکتر شدن کانولاها، افت فشار درون کانولاها و لولهها بهطور تصاعدی افزایش پیدا میکند. این بدان معنا است که پمپ دستگاه (چه پمپ مصنوعی باشد، چه قلب جنین) برای اینکه مایعات را عبور بدهد، باید کار بسیار بیشتری انجام بدهند و این وضعیتی است که پژوهشگران میخواهند از آن اجتناب کنند.
فناوریهای در حال توسعه برای نجات نوزادان بسیار نارس
نوزادان خیلی نارس (آنهایی که قبل از ۲۸ هفتگی متولد میشوند) اغلب زنده نمیمانند و نوزادانی که زنده میمانند، غالبا به علت ریههای رشدنیافتهی خود دچار مشکلاتی میشوند. چندین گروه پژوهشی در حال ایجاد فناوریهایی هستند که میتواند نوزادان نارس را حمایت کند تا زمانیکه بتوانند بهخودیخود نفس بکشند و خصوصاً روی نوزادانی تمرکز دارند که احتمال زندهمانی آنها کم است (حدود ۲۳ یا ۲۴ هفته). این سیستمها هنوز روی انسان آزمایش نشده است، اما آزمایشهای حیوانی امیدوارکننده بوده است.
| فناوری | جفت مصنوعی | بیوبگ | درمان EVE | جفت مصنوعی میکروفلوئیدیک |
| سازنده فناوری | بیمارستان کودکان سیاسموت دانشگاه میشیگان | مؤسسه تحقیقات بیمارستان کودکان فیلادلفیا |
دانشگاه استرالیای غربی، دانشگاه توهوکو و شرکت نیپرو
|
دانشگاه مکمستر و بیمارستان نورمبرگ
|
| روش کار | این جفت مصنوعی اکسیژناتور مورد استفاده در درمان ECMO را به کار میگیرد تا اکسیژن را به نوزاد نارسی که در انکوباتور قرار دارد، برساند | درحالیکه به اکسیژناتور ECMO متصل است، نوزاد درون مایع رحممانندی درون کیسهای غوطهور شده است | درحالیکه به یک اکسیژناتور متصل است، نوزاد در مایع رحممانندی درون کیسهای غوطهور شده است | این سیستم از اکسیژناتور جدیدی استفاده میکند که با تقلید از ساختار عروق خونی ریه به خون اجازه میدهد تا اکسیژن را مستقیما از هوا بگیرد. نوزاد درحالیکه به این دستگاه متصل است، میتواند نفس بکشد. |
| خون چگونه جریان پیدا میکند | از پمپ مکانیکی برای به جریان انداختن خون درون لولهها استفاده میکند | قلب نوزاد خون را به درون سیستم هدایت میکند | قلب نوزاد خون را به درون سیستم هدایت میکند | قلب نوزاد خون را به درون سیستم هدایت میکند |
| چگونه به نوزاد متصل میشود | سیستم خون را از سیاهرگ گردن میگیرد و از طریق سیاهرگ نافی برمیگرداند | این سیستم از سرخرگهای نافی و سیاهرگ نافی استفاده میکند | این سیستم از سرخرگهای نافی و سیاهرگ نافی استفاده میکند | این سیستم از سرخرگهای نافی و سیاهرگ نافی استفاده میکند |
| چگونه مانع از لخته شدن خون میشود | از پوشش خاصی استفاده میکند که مانع از لخته شدن خون درون لولهها میشود و از این طریق، از استفاده از داروهای رقیقکنندهی خون که نوزاد نورس قادر به تحمل آن نیست، اجتناب میکند | این گروه پژوهشی هنوز دادههایی دراینباره منتشر نکرده است | این گروه در حال ایجاد پوششهایی برای اجتناب از استفاده از رقیقکنندههای خون هستند | پژوهشگران در حال آزمایش چندین نوع پوشش برای پرهیز از استفاده از رقیقکنندههای خون هستند |
| پیشرفت فناوری | این جفت مصنوعی در حال حاضر میتواند برههای زودرس را برای چندین هفته زنده نگه دارد. پژوهشگران انتظار دارند فناوری خود را طی پنج سال آینده در نوزادان انسان آزمایش کنند | پژوهش ۲۰۱۷ نشان داد که کیسه زیستی میتواند برههای نارس را تا یک ماه زنده نگه دارد. این تیم انتظار دارد کارآزماییهای بالینی را طی چند سال آینده آغاز کند | این تیم نشان داده است که رویکرد آنها میتواند برههای نارس را برای یک هفته زنده نگه دارد | هنوز در مراحل اولیه آزمایش است. در مطالعه اثبات مفهومی، این سیستم به توله خوک بیماری برای چندین ساعت اکسیژنرسانی کرد |
جوتا آرنس، مهندس بیوشیمی در دانشگاه توئنته هلند که بخشی از شبکهی اروپایی ساخت جفت مصنوعی است، خاطرنشان میکند یکی از مشکلات مهم این است که حجم اکسیژناتورهای تجاری بسیار زیاد است. دستگاههای امروزی ممکن است برای نوزادان سنگینتر با چند صد میلیلیتر خون کار کند، اما برای نوزاد مثلاً ۶۰۰ گرمی با ۶۰ میلیلیتر خون، به کار نمیآید.
وقتی افراد بزرگسال به ECMO متصل میشوند، از محلول نمکی برای بیرون راندن هوا و آماده کردن سیستم استفاده میشود و محلول نمکی وقتی وارد جریان خون بیمار میشود، بهطور بیخطری خون را رقیق میکند. اگرچه در مورد نوزادان نارس درزمینهی تحمل محلول نمکی در خون آنها محدودیتی وجود دارد و خون آنها توانایی انتقال اکسیژن را از دست میدهد. خون اهدایی بزرگسالان نیز ایدهآل نیست، زیرا خواص تبادل گاز کاملا متفاوتی دارد.
در سراسر جهان، تیمهایی روی جفتهای مصنوعی کار میکنند که رویکردهای متفاوتی برای حل این مشکل در نظر گرفتهاند. در حال حاضر، تیم مایچالیسکا در حال آزمایش این مسئله هستند که با اکسیژناتورهای تجاری تا کجا میتوانند پیش بروند درحالیکه گروه آرنس در هلند و گروه کمپ در استرالیا در حال طراحی اکسیژناتورهای کوچکتر و سیستم لوله متناسب برای این بیماران کوچک هستند.
در دانشگاه مکمستر کانادا راوی سلواگاناپاتی، مهندس زیستپزشکی، در حال همکاری با گروهی از پژوهشگران بیمارستان نورمبرگ آلمان روی ساخت نوع کاملا جدیدی از اکسیژناتور است و از ریه بهعنوان الگو استفاده میکنند.
ریهها به دلیل ساختار خاص عروقی خونی در تبادل گاز بسیار مؤثر هستند: شاخههای ورودی بزرگ به شاخههای ریز بیشماری تقسیم میشوند که ضخامت هریک از آنها چند میکرومتر است. این شاخهها فقط به اندازهای بزرگ هستند که سلولهای قرمز خون بتوانند بهطور انفرادی در آنها قرار گیرند و تا آنجا که ممکن است اکسیژن بگیرند.
بهطور مشابهی، سیستم مکمستر-نورمبرگ به شبکهای از لولههای کوچک تقسیم میشود که از سیلیکون نفوذپذیر نسبت به گاز ساخته میشود که از طریق آن سلولهای قرمز خون اکسیژن را از هوا جذب میکنند. سلواگاناپاتی میگوید: «این درست مانند ریه است و هوا را تنفس میکند». گروه او سال گذشته گزارش کرد که این رویکرد میکروفلوئیدیک با موفقیت توله خوک بیماری را برای چند ساعت زنده نگه داشت. بهگفتهینیلز روچو، از اعضای پروژه، مزیت دیگر آن است که واحدهای اکسیژناتور را در صورت نیاز میتوان برای افزایش ظرفیت نوزاد همگام با رشد او اضافه کرد.
طراحی سیستمها برای ظریفترین انسانها به معنای این است که باید اصلاحات ظریف زیادی انجام داد. طرحهای بدون پمپ که بر قلب نوزاد متکی هستند، ممکن است برای نوزادان دچار مشکلات قلبی کارساز نباشند؛ اما روچو متذکر میشود پمپهای مصنوعی میتواند به سلولهای قرمز حملکننده اکسیژن خون آسیب برساند. آرنس میگوید در حال حاضر نمیتوان گفت کدام رویکرد از همه مناسبتر است و ممکن است معلوم شود که همهی ما در مسیر درست قرار داریم، اما برای بیماران متفاوت.
مایچالیسکا انتظار دارد دستگاه او طی پنج سال آینده در نوزادان انسان آزمایش شود درحالیکه تیم CHOP میگوید فقط دو سال با این مرحله فاصله دارند؛ اما دیگران تردید دارند. آنیتا مون گرادی که برنامه قلب و عروق جنین را در دانشگاه کالیفرنیا در سانفرانسیسکو هدایت میکند، میگوید: «فکر میکنم قبل از اینکه در مورد این سیستمها بهعنوان رحم مصنوعی برای استفاده بالینی فکر کنیم، آزمایشهای بسیار بیشتری لازم باشد».
آنا پن، متخصص نئوناتولوژی و متخصص عصبشناسی رشد در دانشگاه کلمبیا میگوید مشخص نیست که نتایج حاصل از گوسفند تا چه حد در انسانها قابل تعمیم باشد. سرعت رشد مغز گوسفند نسبت به مغز انسان متفاوت است و بند ناف گوسفندها بسیار کوتاهتر و صافتر از بند ناف انسان است که هر دو عامل میتواند بر نحوهی عملکرد دستگاه در انسانها اثر داشته باشد. به نظر پن، جفتهای مصنوعی سرانجام وارد کلینیکها خواهند شد، اما اینکه آیا به رویهی متداولی در مراقبتهای ویژه نوزادی تبدیل میشوند یا نه، به مزیتها و خطرات طولانیمدت آنها بستگی دارد.
مقالههای مرتبط:
پن خاطرنشان میکند که جفت فقط مواد غذایی و اکسیژن را به جنین نمیرساند بلکه هورمونها و مواد دیگری نیز از این راه به جنین رسانده میشوند. او میگوید: «فکر میکنم اگر چیزی ساخته شود که بتواند بسیار خوب کار کند، شگفتآور خواهد بود، اما بعید است که هرگز به اندازه جفت طبیعی کارآمد باشد».
از نظر متخصصان اخلاق زیستی نیز جفتهای مصنوعی سؤالات پیچیدهای را ایجاد میکنند. دنا دیویس، متخصص اخلاق زیستی از دانشگاه لیهای در پنسیلوانیا میگوید اگر دستگاه مطابق انتظار کار کند، به نوزاد ۲۴ هفته کمک کند تا با سلامت به ۲۸ هفتگی برسد. در این زمینه، دشوار است که بفهمیم چرا کسی ممکن است با این مسئله مشکلی داشته باشد؛ اما به گفتهی او اگر فناوری روی جنینهای جوانتر استفاده شود، ممکن است مشکلاتی پیش آید. در آمریکا، شرط قانونی برای سقط جنین متکی بر مفهوم قابلیت زیستن، یعنی توانایی زیستن در خارج از بدن مادر است. بیشتر پزشکان میگویند جنین از نظر تئوری در حدود ۲۴ هفتگی قابلیت زیستن دارد. به گفتهی دیویس، اگر جفتهای مصنوعی در جنینهای جوانتر استفاده شود، برخی افراد چنین استدلال خواهند کرد که حتی در سهماههی دوم نیز نوزاد میتواند ماندنی باشد.
سایر متخصصان زیستی و نیز برخی از دانشمندان مسئله بزرگتری را مطرح میکنند: با لقاح آزمایشگاهی که اکنون رایج است و جفت مصنوعی که در حال پیشرفت است، آیا این فناوری ممکن است درنهایت به رحمهای مصنوعی واقعی منجر شود که در آن کودکان بدون مادر رشد میکنند؟
پوشش رسانهای پژوهشهای مرتبط با جفت مصنوعی اغلب چشمانداز رمان «دنیای شگفتانگیز جدید» آلدوس هاکسلی را زنده میکند که آیندهای را به تصویر میکشد که در آن انسانها بهوسیلهی حکومتی استبدادی در بطریهایی بهصورت انبوه تولید میشوند.
از نظر فنی، این خیالات علمی-تخیلی دقیقا به همین شکل باقی میمانند. آرنس میگوید ناتوانی در وارد کردن کانولا به عروق خونی ریز بهتنهایی طراحی جفت مصنوعی را برای هر نوزادی که جوانتر از ۲۲ تا ۲۳ هفته است، غیر ممکن میسازد. علاوه بر این، با وجود هزاران مقالهی علمی که مراحل اولیهی رشد انسان را مورد کاوش قرار میدهند، نادانستههای زیادی دراینباره وجود دارد که رحم چگونه شرایط کامل برای رشد تخمکی بارورشده و تبدیل آن به جنین را فراهم میکند.
گراهام برتون، متخصص زیستشناسی تکوینی از دانشگاه کمبریج میگوید بازآفرینی مصنوعی این فرایند به این زودی ممکن نخواهد بود. مایچالیسکا هم وقتی برای تخیل ندارد. او واقعیتی را ترجیح میدهد که اکنون در مزرعهای در میشیگان زندگی میکند. سالها پیش، تیم تصمیم گرفت تا یک بره قوی متصل به جفت مصنوعی را جدا کنند. آنها حدود یک هفته با بطری به او غذا دادند و او را به مزرعهای اهدا کردند. مارج بزرگ که در ۱۳۰ روزگی از رحم جدا شده بود، نسبت به برههایی که معمولا به سیستم متصل میشدند، بسیار بزرگتر بود و تنها سه روز را تحت حمایت آن گذراند؛ اما این واقعیت که او پنج سال سالم زندگی کرد و حتی دو فرزند به دنیا آورد، نشاندهندهی چیزی است که مایچالیسکا امیدوار است روزی در انسانها به آن دست پیدا کند. برای او، حاصل این تلاشها تنها جلوگیری از مرگ نیست، بلکه ایجاد یک زندگی سالم و فرصتی برای تولید زندگی جدید است و او فکر میکند خیلی به این هدف نزدیک شده است.
 قوی ترین طلسمات+قویترین دعا و طلسم+قوی ترین کتاب طلسم و دعانویسی مطالب مذهبی+طلسم سیاهی و طلاق+طلسم احضار محبت معشوق+دانلود کتاب طلسم محبت و طلاق قوی
قوی ترین طلسمات+قویترین دعا و طلسم+قوی ترین کتاب طلسم و دعانویسی مطالب مذهبی+طلسم سیاهی و طلاق+طلسم احضار محبت معشوق+دانلود کتاب طلسم محبت و طلاق قوی